Wnt Signaling Requires Sequestration of Glycogen Synthase Kinase 3 inside Multivesicular Endosomes
Vincent F. Taelman,1,3 Radoslaw Dobrowolski,1,3 Jean-Louis Plouhinec,1 Luis C. Fuentealba,1,4 Peggy P. Vorwald,1 Iwona Gumper,2 David D. Sabatini,2 and Edward M. De Robertis1, *
Wnt 信号传导需要抑制糖原合酶激酶 3 (GSK3) 活性,但实现这一目标的分子机制仍不清楚。 在此,我们研究 Wnt 信号传导触发 GSK3 从细胞质隔离到多泡体 (MVB) 中,从而使该酶与其许多细胞质底物分离。 内吞的 Wnt 与 GSK3 共定位于内体标记物呈阳性的酸性囊泡中。 添加 Wnt 后,细胞质中的内源性 GSK3 活性降低,并且 GSK3 在膜结合细胞器内免受蛋白酶处理。 冷冻免疫电子显微镜副本显示这些对应于 MVB。 Wnt 信号传导需要两种 MVB 形成所必需的蛋白质:HRS/Vps27 和 Vps4。 GSK3 的隔离延长了除 b-连环蛋白之外的许多其他蛋白质的半衰期,包括含有 GSK3 磷酸化位点的人工 Wnt 调节蛋白。 我们得出结论,多囊泡内体是 Wnt 信号转导途径的重要组成部分.
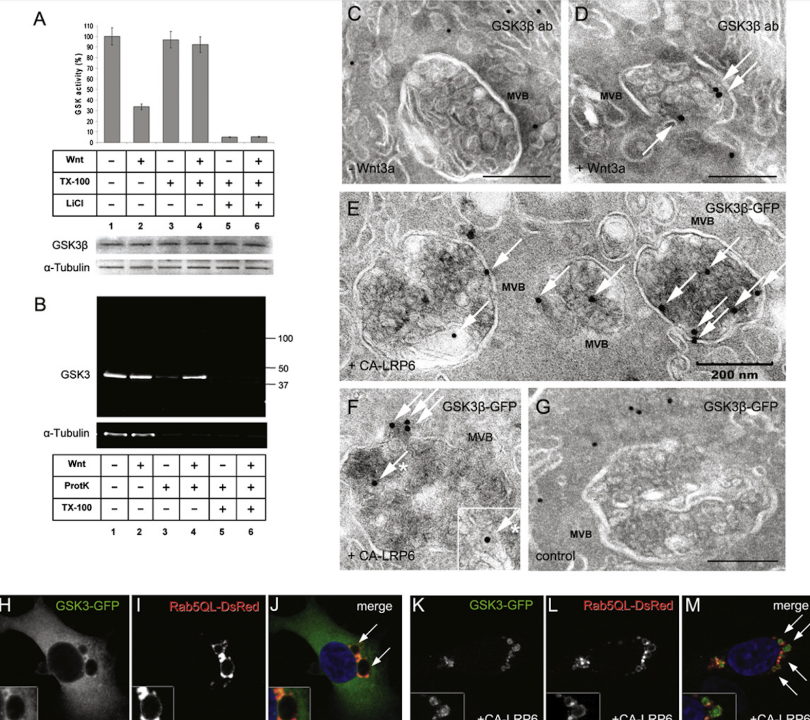
Figure 2: Wnt Signaling Causes Sequestration of GSK3 inside Multivesicular Endosomes
(A) GSK3 Kinase Activity:
GSK3 kinase activity decreased by 66%±5% with Wnt3a treatment and recovered after membrane solubilization with 0.1% Triton X-100 in Digitonin-permeabilized L cells. LiCl inhibition confirms the specificity of the radioactive assay for GSK3. Data are from two independent experiments using untransfected L cells. GSK3 band and α-tubulin provide loading controls.
(B) Proteinase K Protection Assay:
GSK3β becomes protected from Proteinase K after Wnt3a treatment but only in the absence of Triton X-100 (lanes 3–6). Similar results were obtained in five independent experiments with untransfected L cells. All samples were permeabilized with Digitonin, causing leakage of 37% of the endogenous GSK3 (three independent experiments).
(C and D) Cryoimmunoelectron Microscopy:
Demonstrates the relocation of endogenous GSK3β into Multivesicular Bodies (MVBs) (arrows) after Wnt3a treatment in untransfected 3T3 cells.
(E–G) GSK3-GFP Localization:
GSK3-GFP localized in MVBs (white arrows) in CA-LRP6 transfected HeLa cells but was cytosolic in control cells lacking CA-LRP6 transfection.
(H–J) Rab5-QL-DsRed Formation:
Rab5-QL-DsRed forms giant endosomes (arrows), while GSK3β-GFP remains uniformly distributed in the cytosol (n=100).
(K–M) GSK3-GFP Translocation:
In the presence of CA-LRP6, GSK3-GFP is translocated inside Rab5-QL giant multivesicular endosomes (see arrows) in 77%±9%, n=80, of cotransfected cells. Note that GSK3 becomes depleted from the cytosol. Data are represented as mean±SEM.
图 2:Wnt 信号传导导致 GSK3 隔离在多囊泡内体中
(A) GSK3 激酶活性:
在洋地黄皂苷通透的 L 细胞中,Wnt3a 处理后 GSK3 激酶活性降低 66%±5%,并在用 0.1% Triton X-100 进行膜溶解后恢复。 LiCl 抑制证实了 GSK3 放射性测定的特异性。 数据来自使用未转染的 L 细胞的两个独立实验。 GSK3 带和 α-微管蛋白提供上样控制。
(B) 蛋白酶 K 保护测定:
Wnt3a 处理后,GSK3β 受到蛋白酶 K 的保护,但仅在没有 Triton X-100 的情况下(泳道 3-6)。 使用未转染的 L 细胞进行的五次独立实验也获得了类似的结果。 所有样品均用洋地黄皂苷进行透化,导致 37% 的内源 GSK3 渗漏(三个独立实验)。
(C 和 D) 冷冻免疫电子显微镜:
展示未转染的 3T3 细胞中 Wnt3a 处理后内源性 GSK3β 重新定位到多泡体 (MVB)(箭头)中。
(E–G) GSK3-GFP 定位:
GSK3-GFP 位于 CA-LRP6 转染的 HeLa 细胞中的 MVB(白色箭头)中,但在缺乏 CA-LRP6 转染的对照细胞中位于胞质中。
(H–J) Rab5-QL-DsRed 形成:
Rab5-QL-DsRed 形成巨大的内体(箭头),而 GSK3β-GFP 仍然均匀分布在细胞质中 (n=100)。
(K–M) GSK3-GFP 易位:
在存在 CA-LRP6 的情况下,在 77%±9%(n=80)的共转染细胞中,GSK3-GFP 易位到 Rab5-QL 巨型多囊核内体(见箭头)内。 请注意,GSK3 从细胞质中耗尽。 数据表示为平均值±SEM。
The relocalization of GSK3 to multivesicular endosomes in Wnt3a-treated cells was visualized by cryoimmunoelectron microscopy. In untransfected 3T3 cells treated with control conditioned medium, endogenous GSK3β was found almost exclusively in the cytosol, whereas in Wnt3a-treated cells a substantial fraction was found inside MVBs (Figures 2C and 2D). In HeLa cells cotransfected with CA-LRP6 and GSK3-GFP, an anti-GFP antibody revealed colloidal Gold particles in MVBs (Figure 2E). In some cases, Gold particles were observed on the cytoplasmic surface of vesicles fusing with multivesicular endosomes (Figure 2F), as well as within the small vesicles that fill MVBs (arrows with asterisks in Figure 2F), supporting the topology shown in Figure 7. In the absence of CA-LRP6, Gold-labeled GSK3-GFP was located in the cytosol (Figure 2G).通过冷冻免疫电子显微镜观察 GSK3 在 Wnt3a 处理的细胞中重新定位到多囊泡内体。 在用对照条件培养基处理的未转染的 3T3 细胞中,内源性 GSK3β 几乎全部存在于胞质溶胶中,而在 Wnt3a 处理的细胞中,大部分发现于 MVB 内(图 2C 和 2D)。 在用 CA-LRP6 和 GSK3-GFP 共转染的 HeLa 细胞中,抗 GFP 抗体显示 MVB 中存在胶体金颗粒(图 2E)。 在某些情况下,在与多囊泡内体融合的囊泡的细胞质表面上观察到金颗粒(图2F),以及填充MVB的小囊泡内(图2F中带星号的箭头),支持图7所示的拓扑结构。 在没有 CA-LRP6 的情况下,金标记的 GSK3-GFP 位于胞质溶胶中(图 2G)。
Immunostaining and Western Blots
For immunostainings, primary antibodies were: anti-GSK3β monoclonal (BD Transduction #610201) at 1:350, and anti-phospho-b-Catenin (Cell Signaling #9561) at 1:350. For cryoimmunoelectron microscopy, antibodies used were chicken IgY anti-GSK3β (Sigma #GW22779) at 1:800 and chicken IgY anti-GFP (Invitrogen #A10262) at 1:250. For western blots, primary antibodies used were the anti-GSK3β monoclonal at 1:1000, anti-β-Catenin (Sigma #C2206) at 1:4000, anti-a-tubulin monoclonal (Calbiochem #CP06) at 1:1500, anti-Flag monoclonal (Sigma #F1804) at 1:1500, and anti-Total-Erk (Cell Signaling #9102) at 1:1000. Secondary antibodies coupled to InfraRed Dyes (IRDye680 and IRDye800) at 1:3000 (LI-COR) were used, and western blots were analyzed using a LI-COR Odyssey scanner system.
免疫染色和蛋白质印迹
对于免疫染色,一抗为:1:350 的抗 GSK3β 单克隆抗体 (BD Transduction #610201) 和 1:350 的抗磷酸-b-Catenin (Cell Signaling #9561)。 对于冷冻免疫电镜,使用的抗体是 1:800 的鸡 IgY 抗 GSK3β (Sigma #GW22779) 和 1:250 的鸡 IgY 抗 GFP (Invitrogen #A10262)。 对于蛋白质印迹,使用的一抗是 1:1000 的抗 GSK3β 单克隆抗体、1:4000 的抗 β-连环蛋白 (Sigma #C2206)、1:1500 的抗 a-微管蛋白单克隆抗体 (Calbiochem #CP06)、1:1500 的抗 -Flag 单克隆抗体 (Sigma #F1804) 浓度为 1:1500,抗 Total-Erk (Cell Signaling #9102) 浓度为 1:1000。 使用以 1:3000 (LI-COR) 与红外染料(IRDye680 和 IRDye800)偶联的二抗,并使用 LI-COR Odyssey 扫描仪系统分析蛋白质印迹。